Garis waktu kimia

Lini masa kimia memuat daftar karya, penemuan, gagasan, penciptaan, dan eksperimen penting yang secara signifikan mengubah pemahaman manusia tentang sains modern yang dikenal sebagai kimia, yang didefinisikan sebagai studi ilmiah tentang komposisi materi dan interaksinya. Sejarah kimia dalam bentuk modernnya bisa dikatakan dimulai dari ilmuwan Irlandia Robert Boyle, meskipun akarnya dapat ditelusuri kembali ke catatan sejarah paling awal.
Gagasan awal yang kemudian tergabung dalam ilmu kimia modern berasal dari dua sumber utama. Filsuf alam (seperti Aristoteles dan Demokritos) menggunakan penalaran deduktif dalam upaya untuk menjelaskan perilaku dunia di sekitar mereka. Alkimiawan (seperti Jabir dan ar-Razi) adalah orang-orang yang menggunakan teknik eksperimental dalam upaya memperpanjang umur atau melakukan konversi materi, seperti mengubah logam dasar menjadi emas.
Pada abad ke-17, sintesis gagasan kedua disiplin ini, yaitu deduktif dan eksperimental, mengarah pada pengembangan proses berpikir yang dikenal sebagai metode ilmiah. Dengan diperkenalkannya metode ilmiah, lahirlah ilmu kimia modern.
Dikenal sebagai "Templat:Ill", studi kimia sangat dipengaruhi oleh, dan memberi pengaruh kuat pada, banyak bidang ilmiah dan teknologi lainnya. Banyak peristiwa yang dianggap penting bagi pemahaman modern kita tentang kimia juga dianggap sebagai penemuan kunci di bidang, antara lain, fisika, biologi, astronomi, geologi, dan ilmu bahan.[1]
Pra abad ke-17


Sebelum menerima metode ilmiah dan penerapannya pada bidang kimia, agak kontroversial untuk mempertimbangkan banyak orang yang tercantum di bawah ini sebagai "kimiawan" dalam pengertian modern. Namun, gagasan pemikir besar tertentu, baik untuk nurani mereka, atau untuk penerimaan luas dan jangka panjangnya, tercantum di sini.
- c. 3000 SM
- Bangsa Mesir merumuskan teori Templat:Ill, atau "gaya primordial", asal semuanya terbentuk. Inilah unsur khaos, berjumlah delapan, yang ada sebelum penciptaan matahari.[2]
- c. 1200 SM
- Tapputi-Belatikallim, pembuat parfum dan kimiawan awal, disebutkan dalam kuneiform di Mesopotamia.[3]
- c. 450 SM
- Empedokles menegaskan bahwa segala sesuatu terdiri dari empat unsur utama: tanah, udara, api, dan air, di mana dua gaya aktif dan bertentangan, cinta dan kebencian, atau afinitas dan antipati, bertindak berdasarkan unsur-unsur ini, menggabungkan dan memisahkannya menjadi bentuk yang bervariasi.[4]
- c. 440 SM
- Leukippos dan Demokritos mengemukakan gagasan atom, sebuah partikel yang tak terbantahkan bahwa semua materi terbuat darinya. Gagasan ini sebagian besar ditolak oleh para filsuf alam yang mendukung pandangan Aristoteles (lihat di bawah).[5][6]
- c. 360 SM
- Plato mengaitkan istilah 'unsur' (stoicheia) dan dalam dialognya Timaios, yang mencakup diskusi tentang komposisi badan anorganik dan organik dan merupakan risalah dasar kimia, mengasumsikan bahwa partikel kecil dari setiap unsur memiliki bentuk geometris khusus: tetrahedron (api), oktahedron (udara), ikosahedron (air), dan kubus (tanah).[7]
- c. 350 SM
- Aristoteles, mengembangkan teori Empedocles, mengusulkan gagasan tentang zat sebagai kombinasi materi dan bentuk. Menjelaskan teori Lima Unsur, api, air, tanah, udara, dan ether. Teori ini sebagian besar diterima di seluruh dunia barat selama lebih dari 1000 tahun.[8]
- c. 50 SM
- Lucretius menerbitkan De Rerum Natura, sebuah deskripsi puitis tentang gagasan atomisme.[9]
- c. 300
- Zosimos dari Panopolis menulis beberapa buku tertua tentang alkimia, yang dia definisikan sebagai studi tentang komposisi air, gerak, pertumbuhan, penjelmaan dan pengawajelmaan, menarik roh dari tubuh dan mengikat roh di dalam tubuh.[10]
- c. 770
- Abu Musa Jabir bin Hayyan (alias Geber), seorang alkimiawan Arab/Persia yang "dianggap oleh banyak orang sebagai bapak ilmu kimia",[11][12][13] mengembangkan metode eksperimental awal untuk kimia, dan mengisolasi banyak asam, termasuk asam klorida, asam nitrat, asam sitrat, asam asetat, asam tartarat, dan air raja.[14]
- c. 1000
- Abu Raihan Al-Biruni[15] dan Ibnu Sina,[16] keduanya kimiawan Persia, membantah praktik alkimia dan teori transmutasi logam.
- c. 1167
- Magister Salernus dari Schola Medica Salernitana membuat referensi pertama tentang penyulingan anggur.[17]
- c. 1220
- Robert Grosseteste menerbitkan beberapa komentar Aristoteles di mana dia meletakkan kerangka awal metode ilmiah.[18]
- c 1250
- Taddeo Alderotti mengembangkan distilasi fraksional, yang jauh lebih efektif daripada pendahulunya.[19]
- c 1260
- St Albertus Agung menemukan arsen[20] dan perak nitrat.[21] Dia juga membuat salah satu referensi pertama untuk asam sulfat.[22]
- c. 1267
- Roger Bacon menerbitkan Opus Maius, yang antara lain mengusulkan bentuk awal metode ilmiah, dan berisi hasil eksperimennya dengan bubuk mesiu.[23]
- c. 1310
- Templat:Ill, seorang alkimiawan anonim Spanyol yang menulis dengan nama Geber, menerbitkan beberapa buku yang menetapkan teori lama bahwa semua logam terdiri dari berbagai proporsi belerang dan raksa.[24] Dia adalah salah satu yang pertama menjelaskan asam nitrat, air raja, dan aqua fortis.[25]
- c. 1530
- Paracelsus mengembangkan studi tentang iatrokimia (iatrochemistry), sebuah subdisiplin alkimia yang didedikasikan untuk memperpanjang umur, sehingga menjadi akar industri farmasi modern. Ia juga mengklaim bahwa dia adalah orang pertama yang menggunakan kata "chemistry".[10]
- 1597
- Andreas Libavius mempublikasikan Alchemia, sebuah prototipe buku teks kimia.[26]
Abad ke-17 dan ke-18
- 1605
-
- Sir Francis Bacon menerbitkan The Proficience and Advancement of Learning, yang berisi deskripsi tentang apa yang kemudian dikenal sebagai metode ilmiah.[27]
- Michal Sedziwój menerbitkan risalah alkimia A New Light of Alchemy yang mengusulkan adanya "makanan kehidupan" di dalam udara, yang kemudian dikenal sebagai oksigen.[28]
- 1615
- Jean Beguin menerbitkan Tyrocinium Chymicum, sebuah buku teks kimia awal, dan di dalamnya terdapat persamaan kimia untuk pertama kalinya.[29]
- 1637
- René Descartes menerbitkan Discours de la méthode, yang berisi garis besar metode ilmiah.[30]
- 1648
- Publikasi anumerta buku Ortus medicina oleh Jan Baptist van Helmont, yang dikutip oleh beberapa orang sebagai karya transisi besar antara alkimia dan kimia, dan memberi pengaruh penting pada Robert Boyle. Buku ini berisi hasil berbagai eksperimen dan menetapkan versi awal hukum kekekalan massa.[31]

- 1661
- Robert Boyle menerbitkan The Sceptical Chymist, sebuah risalah tentang perbedaan antara kimia dan alkimia. Ini berisi beberapa gagasan modern awal tentang atom, molekul, dan reaksi kimia, dan menandai dimulainya sejarah kimia modern.[32]
- 1662
- Robert Boyle mengusulkan hukum Boyle, deskripsi eksperimen tentang perilaku gas, khususnya hubungan antara tekanan dan volume.[32]
- 1735
- Kimiawan Swedia Georg Brandt menganalisis pigmen biru tua yang ditemukan di bijih tembaga. Brandt menunjukkan bahwa pigmen tersebut mengandung unsur baru, yang kemudian diberi nama kobalt.[33][34]
- 1754
- Joseph Black mengisolasi karbon dioksida, yang ia sebut "udara tetap".[35]

- 1757
- Louis Claude Cadet de Gassicourt, saat menyelidiki senyawa arsen, menciptakan cairan berasap Kadet, yang kemudian ditemukan sebagai kakodil oksida, yang dianggap sebagai senyawa organologam sintetis pertama.[36]
- 1758
- Joseph Black merumuskan konsep kalor laten untuk menjelaskan termokimia of perubahan fase.[37]
- 1766
- Henry Cavendish menemukan hidrogen sebagai gas yang tak berwarna, tak berbau gas yang dapat terbakar dan dapat membentuk sebuah campuran eksplosif dengan udara.[38]
- 1773–1774
- Carl Wilhelm Scheele dan Joseph Priestley seara terpisah mengisolasi oksigen, Priestley menyebutnya "udara terdeflogitikasi", ("dephlogisticated air") dan Scheele menyebutnya "udara api" ("fire air").[39][40]

- 1778
- Antoine Lavoisier, yang dianggap sebagai "bapak kimia modern",[41] mengenali dan memberi nama oksigen, dan menyadari pentingnya dan perannya dalam pembakaran.[42]
- 1787
-
- Antoine Lavoisier mempublikasikan Méthode de nomenclature chimique, sistem tata nama kimia modern pertama.[42]
- Jacques Charles mengusulkan hukum Charles, melengkapi hukum Boyle, yang menjelaskan hubungan antara suhu dan volume gas.[43]
- 1789
- Antoine Lavoisier menerbitkan Traité Élémentaire de Chimie, buku teks kimia modern pertama. Ini adalah survei lengkap tentang kimia modern, termasuk definisi ringkas pertama tentang hukum kekekalan massa, dan juga mewakili pendirian disiplin ilmu stoikiometri atau analisis kimia kuantitatif.[42][44]
- 1797
- Joseph Proust mengusulkan hukum perbandingan tetap, yang menyatakan bahwa unsur-unsur selalu bergabung dalam rasio bilangan bulat kecil untuk membentuk senyawa.[45]
- 1800
- Alessandro Volta merancang baterai kimia pertama, sehingga menemukan disiplin ilmu elektrokimia.[46]
Abad ke-19

- 1801
- John Dalton mengusulkan hukum Dalton, yang menjelaskan hubungan antara komponen dalam campuran gas dan tekanan relatif yang masing-masing berkontribusi pada campuran keseluruhan.[47]
- 1805
- Joseph Louis Gay-Lussac menemukan bahwa air tersusun atas dua bagian hidrogen dan satu bagian oksigen berdasarkan volume.[48]
- 1808
-
- Joseph Louis Gay-Lussac mengumpulkan dan menemukan beberapa sifat kimia dan fisika udara dan gas lainnya, termasuk bukti eksperimental tentang hukum Boyle dan Charles, dan hubungan antara densitas dan komposisi gas.[49]
- John Dalton menerbitkan New System of Chemical Philosophy, yang berisi deskripsi ilmiah modern tentang teori atom, dan deskripsi yang jelas tentang hukum perbandingan berganda.[47]
- Jöns Jakob Berzelius mempublikasikan Lärbok i Kemien yang di dalamnya ia mengusulkan notasi dan simbol kimia, serta konsep massa atom relatif.[50]
- 1811
- Amedeo Avogadro mengusulkan hukum Avogadro, yang menyatakan bahwa untuk volume gas yang sama, di bawah suhu dan tekanan konstan, memiliki jumlah molekul yang sama.[51]
- 1825
- Friedrich Wöhler dan Justus von Liebig melakukan penemuan terkonfirmasi dan penjelasan pertama tentang isomer, yang sebelumnya telah diberi nama tersebut oleh Berzelius. Bekerja dengan asam sianat dan asam fulminat, mereka menyimpulkan dengan tepat bahwa isomerisme disebabkan oleh penataan yang berbeda dari atom-atom di dalam sturktur molekul.[52]
- 1827
- William Prout mengklasifikasikan biomolekul ke dalam pengelompokan modern sebagai: karbohidrat, protein dan lipida.[53]
- 1828
- Friedrich Wöhler mensintesis urea, sehingga memantapkan bahwa senyawa organik dapat dibuat dari bahan mentah anoragnik, menyanggah teori vitalisme.[52]
- 1832
- Friedrich Wöhler dan Justus von Liebig menemukan dan menjelaskan gugus fungsional dan radikal dalam hubungannya dengan kimia organik.[52]
- 1840
- Germain Hess mengusulkan hukum Hess, sebuah pernyataan awal tentang hukum kekekalan energi, yang menetapkan bahwa perubahan energi dalam proses kimia hanya bergantung pada keadaan bahan awal dan produk dan bukan pada jalur spesifik yang diambil antara kedua keadaan tersebut.[54]
- 1847
- Hermann Kolbe memperoleh asam asetat dari sumber yang sepenuhnya anorganik, sanggahan lebih lanjut terhadap vitalisme.[55]
- 1848
- Lord Kelvin menetapkan konsep nol mutlak, suhu di mana seluruh gerak molekul terhenti.[56]
- 1849
- Louis Pasteur menemukan bahwa bentuk rasemat dari asam tartarat adalah suatu campuran dari bentuk levorotatori dan dekstrotatori, dengan demikian mengklarifikasi sifat rotasi optik dan memajukan bidang stereokimia.[57]
- 1852
- August Beer mengusulkan hukum Beer, yang menjelaskan hubungan antara komposisi campuran dan jumlah cahaya yang akan diserapnya. Berdasarkan sebagian dari karya sebelumnya oleh Pierre Bouguer dan Johann Heinrich Lambert, ia menetapkan teknik analisis yang dikenal sebagai spektrofotometri.[58]
- 1855
- Benjamin Silliman, Jr. merintis metode perengkahan minyak bumi, yang memungkinkan terjadinya industri petrokimia modern.[59]
- 1856
- William Henry Perkin mensintesis mauveina, pewarna sintetis pertama. Dibuat sebagai produk sampingan yang tidak disengaja untuk menciptakan kuinina dari tar batubara. Penemuan ini merupakan dasar industri sintesis zat warna, salah satu industri kimia yang berhasil paling awal.[60]
- 1857
- Friedrich August Kekulé von Stradonitz mengusulkan bahwa karbon adalah tetravalen, atau membentuk tepat empat ikatan kimia.[61]
- 1859–1860
- Gustav Kirchhoff dan Robert Bunsen meletakkan landasan spektroskopi sebagai alat analisis kimias, yang mengarahkan mereka pada penemuan sesium dan rubidium. Peneliti lain segera menggunakan teknik yang sama untuk menemukan indium, talium, dan helium.[62]
- 1860
- Stanislao Cannizzaro, membangkitkan gagasan Avogadro mengenai molekul diatomik, menyusun sebuah tabel berdasarkan berat atom dan menyajikannya pada Kongres Karlsruhe tahun 1860, yang mengakhiri konflik puluhan tahun antara berat atom dan rumus molekul, dan mengarahkan Mendeleev menemukan hukum periodik.[63]
- 1862
-
- Alexander Parkes memamerkan Parkesine, salah satu polimer sintetis paling awal, di Pameran Internasional di London. Penemuan ini merupakan landasan industri plastik modern.[64]
- Alexandre-Emile Béguyer de Chancourtois menerbitkan heliks telurik, sebuah versi tiga dimensi tabel periodik unsur kimia.[65]
- 1864
-
- John Newlands mengusulkan hukum oktaf, pendahulu dari hukum periodik.[65]
- Lothar Meyer mengembangkan versi awal tabel periodik, dengan 28 unsur yang diatur berdasarkan valensi.[66]
- Cato Maximilian Guldberg dan Peter Waage, yang membangun berdasarkan gagasan Claude Louis Berthollet, mengusulkan hukum aksi massa.[67][68][69]
- 1865
-
- Johann Josef Loschmidt menentukan jumlah molekul yang tepat dalam satu mol, yang kemudian dinamakan bilangan Avogadro.[70]
- Friedrich August Kekulé von Stradonitz, yang sebagian berdasarkan pada karya Loschmidt dan lainnya, membentuk struktur benzena sebagai enam cincin karbon dengan ikatan berselang-seling tunggal dan ganda.[61]
- Adolf von Baeyer mulai mengerjakan pewarna indigo, sebuah tonggak sejarah dalam industri kimia organik modern yang merevolusi industri zat warna.[71]

- 1869
- Dmitri Mendeleev menerbitkan tabel periodik modern pertama, dengan 66 unsur yang diketahui saat itu dan diatur menurut berat atom. Kekuatan tabelnya adalah kemampuannya untuk secara akurat memprediksi sifat unsur yang belum diketahui.[65][66]
- 1873
- Jacobus Henricus van 't Hoff dan Joseph Achille Le Bel, yang bekerja secara terpisah, mengembangkan model ikatan kimia yang menjelaskan eksperimen kiralitas Pasteur dan menyajikan penyebab fisik aktivitas optik pada senyawa khiral.[72]
- 1876
- Josiah Willard Gibbs menerbitkan On the Equilibrium of Heterogeneous Substances, kompilasi karyanya tentang termodinamika dan kimia fisik yang menjelaskan konsep energi bebas untuk menjelaskan dasar fisika kesetimbangan kimia.[73]
- 1877
- Ludwig Boltzmann menetapkan derivasi statistik dari banyak konsep penting fisika dan kimia, termasuk entropi, dan distribusi kecepatan molekul dalam fase gas.[74]
- 1883
- Svante Arrhenius mengembangkan teori ion untuk menjelaskan konduktivitas elektrolit.[75]
- 1884
-
- Jacobus Henricus van 't Hoff mempublikasikan Études de Dynamique chimique, suatu studi seminal tentang kinetika kimia.[76]
- Hermann Emil Fischer mengusulkan struktur purina, sebuah struktur kunci dalam banyak biomolekul, yang kemudian disintesisnya pada tahun 1898. Juga mulai meneliti tentang kimia glukosa dan gula terkait.[77]
- Henry Louis Le Chatelier mengembangkan prinsip Le Chatelier, yang menjelaskan respon dinamis kesetimbangan kimia terhadap tekanan eksternal.[78]
- 1885
- Eugene Goldstein menyebutkan sinar katode, yang kemudian ditemukan terdiri dari elektron, dan sinar kanal, kemudian ditemukan sebagai ion hidrogen positif yang telah dilucuti dari elektron mereka dalam tabung sinar katode. Ini kemudian diberi nama proton.[79]
- 1893
- Alfred Werner menemukan struktur oktahedral kompleks kobalt, sehingga membentuk bidang ilmu kimia koordinasi.[80]
- 1894–1898
- William Ramsay menemukan gas mulia, yang mengisi celah besar dan tak terduga pada tabel periodik dan menghasilkan model ikatan kimia.[81]
- 1897
- J. J. Thomson menemukan elektron menggunakan tabung sinar katode.[82]
- 1898
-
- Wilhelm Wien menunjukkan bahwa sinar kanal (aliran ion positif) dapat dibelokkan oleh medan magnet, dan jumlah defleksi sebanding dengan rasio massa terhadap muatan. Penemuan ini akan mengarah pada teknik analisis yang dikenal dengan spektrometri massa.[83]
- Maria Sklodowska-Curie dan Pierre Curie mengisolasi radium dan polonium dari pitchblende.[84]
- c. 1900
- Ernest Rutherford menemukan sumber radioaktivitas sebagai peluruhan atom; istilah baru untuk berbagai jenis radiasi.[85]
Abad ke-20
- 1903
- Mikhail Semyonovich Tsvet menemukan kromatografi, suatu teknik analisis penting.[86]
- 1904
- Hantaro Nagaoka mengusulkan model nuklir atom awal, di mana elektron mengorbit inti atom masif.[87]
- 1905
-
- Fritz Haber dan Carl Bosch mengembangkan proses Haber untuk membuat amonia dari unsur-unsurnya, sebuah tonggak sejarah dalam kimia industri yang memiliki dampak besar dalam bidang pertanian.[88]
- Albert Einstein menjelaskan gerak Brown dengan cara yang secara definitif membuktikan teori atom.[89]
- 1907
- Leo Hendrik Baekeland menciptakan bakelite, salah satu plastik komersial pertama yang sukses.[90]

- 1909
-
- Robert Millikan mengukur muatan elektron dengan akurasi yang belum pernah terjadi sebelumnya melalui eksperimen tetes minyak, yang memastikan bahwa semua elektron memiliki muatan dan massa yang sama.[91]
- S. P. L. Sørensen menciptakan konsep pH dan mengembangkan metode untuk mengukur keasaman.[92]
- 1911
-
- Antonius van den Broek mengusulkan gagasan bahwa unsur pada tabel periodik lebih baik disusun berdasarkan muatan inti positif daripada berat atom.[93]
- Konferensi Solvay pertama diadakan di Brussels, mempertemukan sebagian besar ilmuwan paling terkemuka saat itu. Konferensi di bidang fisika dan kimia terus diadakan secara berkala sampai hari ini.[94]
- Ernest Rutherford, Hans Geiger, dan Ernest Marsden melakukan eksperimen foil emas, yang membuktikan model nuklir atom, dengan nukleus positif kecil dan padat dikelilingi oleh awan elektron yang menyebar.[85]
- 1912
-
- William Henry Bragg dan William Lawrence Bragg mengusulkan hukum Bragg dan membangun bidang kristalografi sinar-X, alat penting untuk mengelusidasi struktur kristal zat.[95]
- Peter Debye mengembangkan konsep dipol molekul untuk menjelaskan distribusi muatan asimetris dalam beberapa molekul.[96]
- 1913
-
- Niels Bohr memperkenalkan konsep mekanika kuantum pada struktur atom dengan mengusulkan apa yang sekarang dikenal sebagai model atom Bohr, di mana elektron hanya ada dalam orbital yang didefinisikan secara ketat.[97]
- Henry Moseley, yang bekerja dari gagasan Van den Broek sebelumnya, memperkenalkan konsep nomor atom untuk memperbaiki kekurangan tabel periodik Mendeleev, yang didasarkan pada berat atom.[98]
- Frederick Soddy mengusulkan konsep isotop, unsur yang memiliki sifat kimia yang sama mungkin memiliki bobot atom yang berbeda.[99]
- J. J. Thomson yang mengembangkan karya Wien, menunjukkan bahwa partikel subatomik bermuatan dapat dipisahkan berdasarkan rasio massa terhadap muatan mereka, sebuah teknik yang dikenal sebagai spektrometri massa.[100]
- 1916
- Gilbert N. Lewis mempublikasikan "Atom dan Molekul" ("The Atom and the Molecule"), dasar teori ikatan valensi.[101]
- 1921
- Otto Stern dan Walther Gerlach menetapkan konsep spin mekanis kuantum dalam partikel subatomik.[102]
- 1923
-
- Gilbert N. Lewis dan Merle Randall mempublikasikan "Termodinamika dan Energi Bebas Zat Kimia" ("Thermodynamics and the Free Energy of Chemical Substances"), risalah modern pertama tentang termodinamika kimia.[103]
- Gilbert N. Lewis mengembangkan teori pasangan elektron dari reaksi asam/basa.[101]
- 1924
- Louis de Broglie memperkenalkan model gelombang struktur atom, berdasarkan gagasan dualitas gelombang-partikel.[104]
- 1925
- Wolfgang Pauli mengembangkan prinsip pengecualian, yang menyatakan bahwa tidak ada dua elektron yang mengelilingi satu inti dengan keadaan kuantum yang sama, seperti yang dijelaskan oleh empat bilangan kuantum.[105]
- 1926
- Erwin Schrödinger mengusulkan persamaan Schrödinger, yang memberikan dasar matematika untuk model gelombang struktur atom.[106]
- 1927
-
- Werner Heisenberg mengembangkan prinsip ketidakpastian yang, antara lain, menjelaskan mekanisme gerak elektron di sekitar nukleus.[107]
- Fritz London dan Walter Heitler menerapkan mekanika kuantum untuk menjelaskan ikatan kovalen dalam molekul hidrogen,[108] yang menandai kelahiran kimia kuantum.[109]
- 1929
- Linus Pauling menerbitkan aturan Pauling, yang merupakan prinsip kunci dalam penggunaan kristalografi sinar-X untuk menentukan struktur molekul.[110]
- 1931
-
- Erich Hückel mengusulkan aturan Hückel, yang menjelaskan saat molekul cincin planar akan memiliki sifat aromatik.[111]
- Harold Urey menemukan deuterium dengan distilasi fraksional hidrogen cair.[112]

- 1932
- James Chadwick menemukan neutron.[113]
- 1932–1934
- Linus Pauling dan Robert Mulliken mengukur elektronegativitas, merancang skala yang sekarang memakai nama mereka.[114]
- 1935
- Wallace Carothers memimpin sebuah tim ahli kimia di DuPont yang menciptakan nilon, salah satu polimer sintetis yang paling sukses secara komersial dalam sejarah.[115]
- 1937
-
- Carlo Perrier dan Emilio Segrè melakukan sintesis technetium-97 yang pertama dikonfirmasi, unsur buatan yang pertama diproduksi, mengisi celah di tabel periodik. Meski menuai perdebatan, unsur tersebut mungkin telah disintesis sejak 1925 oleh Walter Noddack dan lainnya.[116]
- Eugene Houdry mengembangkan metode perengkahan katalitik minyak bumi berskala industri, yang memicu pengembangan kilang minyak modern pertama.[117]
- Pyotr Kapitsa, John Allen dan Don Misener membuat helium-4 superdingin, superfluida berviskositas nol pertama, zat yang menampilkan sifat mekanika kuantum pada skala makroskopik.[118]
- 1938
- Otto Hahn menemukan proses fisi nuklir dalam uranium dan torium.[119]
- 1939
- Linus Pauling mempublikasikan The Nature of the Chemical Bond, sebuah kompilasi dari beberapa dekade meneliti ikatan kimia. Ini adalah salah satu naskah kimia modern yang paling penting. Naskah ini menjelaskan teori hibridisasi, ikatan kovalen dan ikatan ionik seperti yang dijelaskan melalui elektronegativitas, dan resonansi sebagai sarana untuk menjelaskan, antara lain, struktur benzena.[110]
- 1940
- Edwin McMillan dan Philip H. Abelson mengidentifikasi neptunium, unsur transuranium yang paling ringan dan pertama disintesis, ditemukan pada produk fisi uranium. McMillan mendirikan sebuah laboratorium di Berkeley yang akan terlibat dalam penemuan banyak unsur dan isotop baru.[120]
- 1941
- Glenn T. Seaborg mengambil alih pekerjaan McMillan yang menciptakan inti atom baru. Perintis metode penangkapan neutron dan kemudian melalui reaksi nuklir lainnya. Kelak ia menjadi penemu utama atau penemu pendamping dari sembilan unsur kimia baru, dan puluhan isotop baru dari unsur yang ada.[120]
- 1945
- Jacob A. Marinsky, Lawrence E. Glendenin, dan Charles D. Coryell melakukan sintesis pertama Promethium yang dikonfirmasi, mengisi "celah" terakhir dalam tabel periodik.[121]
- 1945–1946
- Felix Bloch dan Edward Mills Purcell mengembangkan proses resonansi magnet inti, teknik analisis penting dalam mengelusidasi struktur molekul, terutama dalam kimia organik.[122]
- 1951
- Linus Pauling menggunakan kristalografi sinar-X untuk menyimpulkan struktur sekunder protein.[110]
- 1952
-
- Alan Walsh mempelopori bidang spektroskopi serapan atom, metode spektroskopi kuantitatif penting yang memungkinkan seseorang mengukur konsentrasi materi tertentu dalam campuran.[123]
- Robert Burns Woodward, Geoffrey Wilkinson, and Ernst Otto Fischer menemukan struktur Templat:Ill, salah satu penemuan yang mendasari berdirinya bidang kimia organologam.[124]
- 1953
- James D. Watson and Francis Crick mengusulkan struktur DNA, membuka pintu menuju bidang biologi molekular.[125]
- 1957
- Jens Skou menemukan [[Na+/K+-ATPase|NaTemplat:Sup/KTemplat:Sup-ATPase]], enzim pengangkut ion pertama.[126]
- 1958
- Max Perutz dan John Kendrew menggunakan kristalografi sinar-X untuk mengelusidasi struktur protein, khususnya myoglobin paus kepala kotak.[127]
- 1962
- Neil Bartlett mensintesis xenon heksafluoroplatinat, menunjukkan untuk pertama kalinya bahwa gas mulia dapat membentuk senyawa kimia.[128]
- 1962
- George Olah mengamati karbokation melalui reaksi superasam.[129][130][131]
- 1964
- Richard R. Ernst melakukan eksperimen yang kelak mengarah pada pengembangan teknik NMR transformasi Fourier. Ini sangat meningkatkan sensitivitas teknik, dan membuka pintu untuk magnetic resonance imaging atau MRI.[132]
- 1965
- Robert Burns Woodward dan Roald Hoffmann mengusulkan aturan Woodward–Hoffmann, yang menggunakan simetri orbital molekul untuk menjelaskan stereokimia reaksi kimia.[124]
- 1966
- Hitoshi Nozaki and Ryōji Noyori menemukan contoh pertama katalisis asimetris (hidrogenasi) menggunakan kompleks khiral logam transisi yang didefinisikan dengan baik.[133][134]
- 1970
- John Pople mengembangkan program Gaussian yang sangat mempermudah kalkulasi kimia komputasi.[135]
- 1971
- Yves Chauvin menawarkan penjelasan tentang mekanisme reaksi metatesis olefin.[136]
- 1975
- Karl Barry Sharpless dan timnya menemukan reaksi oksidasi stereoselektif termasuk epoksidasi Sharpless,[137][138] dihidroksilasi asimetris Sharpless,[139][140][141] dan oksiaminasi Sharpless.[142][143][144]
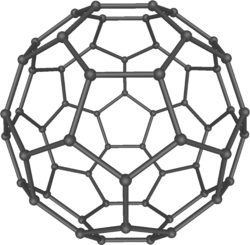
- 1985
- Harold Kroto, Robert Curl dan Richard Smalley menemukan fulerena, sebuah kelas molekul karbon besar yang menyerupai kubah geodesi yang dirancang oleh arsitek R. Buckminster Fuller.[145]
- 1991
- Sumio Iijima menggunakan mikroskop elektron untuk menemukan jenis fulerena silinder yang dikenal sebagai tabung nano karbon, meski karya sebelumnya telah dilakukan di bidang ini pada awal tahun 1951. Bahan ini merupakan komponen penting dalam bidang nanoteknologi.[146]
- 1994
- Sintesis total pertama Taxol oleh Robert A. Holton dan timnya.[147][148][149]
- 1995
- Eric Cornell dan Carl Wieman menghasilkan kondensat Bose–Einstein pertama, zat yang menampilkan sifat mekanika kuantum pada skala makroskopik.[150]
Lihat juga
Referensi
Bacaan lebih lanjut
- Servos, John W., Physical chemistry from Ostwald to Pauling: the making of a science in America Templat:Webarchive, Princeton, N.J.: Princeton University Press, 1990. Templat:ISBN
Pranala luar
- Eric Weisstein's World of Scientific Biography Templat:Webarchive
- History of Gas Chemistry Templat:Webarchive
- list of all Nobel Prize laureates Templat:Webarchive
- History of Elements of the Periodic Table Templat:Webarchive
- ↑ Templat:Cite web
- ↑ Templat:Cite journal
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 10,0 10,1 Templat:Cite book
- ↑ Templat:Citation
- ↑ John Warren (2005). "War and the Cultural Heritage of Iraq: a sadly mismanaged affair", Third World Quarterly, Volume 26, Issue 4 & 5, p. 815-830.
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite journal
- ↑ Robert Briffault (1938). The Making of Humanity, p. 196-197.
- ↑ Templat:Cite book
- ↑ Templat:Cite CE1913
- ↑ Templat:Cite book
- ↑ Templat:Cite book
- ↑ Templat:Cite web
- ↑ Vladimir Karpenko, John A. Norris(2001), Vitriol in the history of Chemistry Templat:Webarchive, Charles University
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Encyclopædia Britannica 1911, Alchemy Templat:Webarchive
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite journal
- ↑ Templat:Cite CE1913
- ↑ Templat:Cite web
- ↑ 32,0 32,1 Templat:Cite web
- ↑ Georg Brandt first showed cobalt to be a new metal in: G. Brandt (1735) "Dissertatio de semimetallis" (Dissertation on semi-metals), Acta Literaria et Scientiarum Sveciae (Journal of Swedish literature and sciences), vol. 4, pages 1–10.
See also: (1) G. Brandt (1746) "Rön och anmärkningar angäende en synnerlig färg — cobolt" (Observations and remarks concerning an extraordinary pigment — cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol.7, pages 119–130; (2) G. Brandt (1748) "Cobalti nova species examinata et descripta" (Cobalt, a new element examined and described), Acta Regiae Societatis Scientiarum Upsaliensis (Journal of the Royal Scientific Society of Uppsala), 1st series, vol. 3, pages 33–41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) "Rediscovery of the Elements: Riddarhyttan, Sweden," Templat:Webarchive The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8. - ↑ Templat:Cite journal
- ↑ Templat:Cite web
- ↑ Templat:Cite journal
- ↑ Templat:Cite book
- ↑ Templat:Cite journal
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ "Lavoisier, Antoine." Encyclopædia Britannica. 2007. Encyclopædia Britannica Online. 24 July 2007 <http://www.britannica.com/eb/article-9369846 Templat:Webarchive>.
- ↑ 42,0 42,1 42,2 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite book
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 47,0 47,1 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 52,0 52,1 52,2 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 61,0 61,1 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Eric R. Scerri, The Periodic Table: Its Story and Its Significance, Oxford University Press, 2006.
- ↑ Templat:Cite web
- ↑ 65,0 65,1 65,2 Templat:Cite web
- ↑ 66,0 66,1 Templat:Cite web
- ↑ C.M. Guldberg and P. Waage,"Studies Concerning Affinity" C. M. Forhandlinger: Videnskabs-Selskabet i Christiana (1864), 35
- ↑ P. Waage, "Experiments for Determining the Affinity Law",Forhandlinger i Videnskabs-Selskabet i Christiania, (1864) 92.
- ↑ C.M. Guldberg, "Concerning the Laws of Chemical Affinity", C. M. Forhandlinger i Videnskabs-Selskabet i Christiania (1864) 111
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 85,0 85,1 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 101,0 101,1 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite journal
- ↑ Ivor Grattan-Guinness. Companion Encyclopedia of the History and Philosophy of the Mathematical Sciences. Johns Hopkins University Press, 2003, p. 1266.; Jagdish Mehra, Helmut Rechenberg. The Historical Development of Quantum Theory. Springer, 2001, p. 540.
- ↑ 110,0 110,1 110,2 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite journal
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 120,0 120,1 Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ 124,0 124,1 Templat:Cite journal note: authorization required for web access.
- ↑ Templat:Cite web
- ↑ Templat:Cite journal
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ G. A. Olah, S. J. Kuhn, W. S. Tolgyesi, E. B. Baker, J. Am. Chem. Soc. 1962, 84, 2733
- ↑ G. A. Olah, lieu. Chim. (Bucharest), 1962, 7, 1139 (Nenitzescu issue)
- ↑ G. A. Olah, W. S. Tolgyesi, S. J. Kuhn, M. E. Moffatt, I. J. Bastien, E. B. Baker, J. Am. Chem. Soc. 1963, 85, 1328.
- ↑ Templat:Cite web
- ↑ H. Nozaki, S. Moriuti, H. Takaya, R. Noyori, Tetrahedron Lett. 1966, 5239;
- ↑ H. Nozaki, H. Takaya, S. Moriuti, R. Noyori, Tetrahedron 1968, 24, 3655.
- ↑ W. J. Hehre, W. A. Lathan, R. Ditchfield, M. D. Newton, and J. A. Pople, Gaussian 70 (Quantum Chemistry Program Exchange, Program No. 237, 1970).
- ↑ Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques Die Makromolekulare Chemie Volume 141, Issue 1, Date: 9 February 1971, Pages: 161–176 Par Jean-Louis Hérisson, Yves Chauvin Templat:DOI
- ↑ Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (Templat:DOI)
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985). (Article Templat:Webarchive)
- ↑ Jacobsen, E. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; Sharpless, K. B. J. Am. Chem. Soc. 1988, 110, 1968. (Templat:DOI)
- ↑ Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483–2547. (Review) (Templat:DOI)
- ↑ Gonzalez, J.; Aurigemma, C.; Truesdale, L. Org. Syn., Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). (Article Templat:Webarchive)
- ↑ Sharpless, K. B.; Patrick, D. W.; Truesdale, L. K.; Biller, S. A. J. Am. Chem. Soc. 1975, 97, 2305. (Templat:DOI)
- ↑ Herranz, E.; Biller, S. A.; Sharpless, K. B. J. Am. Chem. Soc. 1978, 100, 3596–3598. (Templat:DOI)
- ↑ Herranz, E.; Sharpless, K. B. Org. Syn., Coll. Vol. 7, p.375 (1990); Vol. 61, p.85 (1983). (Article Templat:Webarchive)
- ↑ Templat:Cite web
- ↑ Templat:Cite web
- ↑ First total synthesis of taxol 1. Functionalization of the B ring Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, et al.; J. Am. Chem. Soc.; 1994; 116(4); 1597–1598. DOI Abstract Templat:Webarchive
- ↑ First total synthesis of taxol. 2. Completion of the C and D rings Robert A. Holton, Hyeong Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, and et al. J. Am. Chem. Soc.; 1994; 116(4) pp 1599–1600 DOI Abstract Templat:Webarchive
- ↑ A synthesis of taxusin Robert A. Holton, R. R. Juo, Hyeong B. Kim, Andrew D. Williams, Shinya Harusawa, Richard E. Lowenthal, Sadamu Yogai J. Am. Chem. Soc.; 1988; 110(19); 6558–6560. Abstract Templat:Webarchive
- ↑ Templat:Cite web