Titik didih
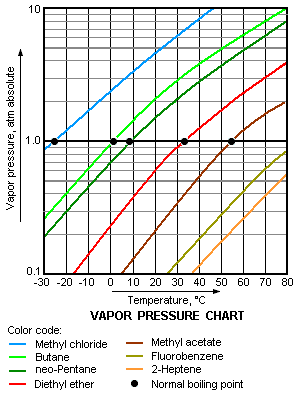
Titik didih adalah suhu ketika tekanan uap sebuah zat cair sama dengan tekanan eksternal yang dialami oleh cairan.[1] Sebuah cairan di dalam vakum akan memiliki titik didih yang rendah dibandingkan jika cairan itu berada di dalam tekanan atmosfer. Cairan yang berada di dalam tekanan tinggi akan memiliki titik didih lebih tinggi jika dibandingkan dari titik didihnya di dalam tekanan atmosfer.
Titik didih normal (juga disebut titik didih atmosferis) dari sebuah cairan merupakan kasus istimewa ketika tekanan uap cairan sama dengan tekanan atmosfer di permukaan laut, satu atmosfer. Pada suhu ini, tekanan uap cairan bisa mengatasi tekanan atmosfer dan membentuk gelembung di dalam massa cair. Pada saat ini (per 1982) Standar Titik Didih yang ditetapkan oleh IUPAC adalah suhu ketika pendidihan terjadi pada tekanan "1 bar".[2]
Pada suhu dan tekanan standar (76 cmHg, 25 °C) air memiliki titik didih air pada suhu "100 °C".
Kejenuhan suhu
Jika panas penguapan dan tekanan uap dari sebuah cairan pada suhu tertentu diketahui, maka titik didih normal bisa dihitung dengan menggunakan persamaan Clausius–Clapeyron:
| = titik didih, K | |
| = konstanta gas ideal, 8,314 J · K−1 · mol−1 | |
| = tekanan uap pada temperatur tertentu, kPa | |
| = tekanan atmosfer, kPa | |
| = kalor penguapan dari fluida, J/mol | |
| = temperatur, K | |
| = logaritma natural |
Lihat pula
- Ebulliometer
- Kenaikan titik didih
- Metode Joback
- Suhu Hagedorn
- Titik beku
- Titik kritis
- Titik lebur
- Titik tripel