Aluminium klorida
Aluminium klorida (AlCl3) adalah senyawa kimia utama dari aluminium dan klorin. Senyawa ini berwarna putih, tetapi sampelnya sering terkontaminasi dengan besi triklorida, yang memberikan pewarnaan kuning. Padatannya mempunyai titik leleh dan titik didih rendah. Senyawa ini terutama diproduksi dan dikonsumsi dalam produksi logam aluminium, tetapi sejumlah besar juga digunakan dalam bidang industri kimia. Senyawa ini sering digolongkan sebagai asam Lewis. Ini merupakan contoh senyawa anorganik yang retak pada temperatur rendah, berubah bolak-balik dari polimer menjadi monomer.
Struktur
Templat:Chem2 memiliki tiga struktur yang berbeda, bergantung pada temperatur dan fasenya (padat, cair, gas). Templat:Chem2 padat berbentuk seperti lembaran dengan kisi kristal closed packed cubic. Dalam bentuk ini, pusat Al menunjukkan geometri koordinasi oktahedral.[1] Dalam lelehannya, aluminium triklorida berada sebagai dimer Templat:Chem2, dengan aluminium tetrakoordinasi. Perubahan struktur ini terkait dengan rendahnya massa jenis fasa cairnya (1,78 g/cm3) vs aluminium triklorida padat (2,48 g/cm3). Dimer Al2Cl6 juga dijumpai dalam fasa uap. Pada temperatur yang lebih tinggi, dimer Al2Cl6 terdisosiasi menjadi Templat:Chem2 trigonal planar, yang secara struktur analog dengan [[Boron trifluorida|Templat:Chem2]]. Lelehannya memiliki daya hantar listrik rendah,[2] tidak seperti halida ionik lainnya misalnya natrium klorida.
Reaksi
Aluminium klorida anhidrat adalah asam Lewis kuat, mampu membentuk adisi asam-basa Lewis dengan basa Lewis seperti benzofenon dan mesitilena.[3] Ia membentuk tetrakloroaluminat Templat:Chem2 dengan adanya ion klorida.
Aluminium klorida bereaksi dengan kalsium dan magnesium hidrida dalam tetrahidrofuran membentuk tetrahidroaluminat.
Reaksi dengan air
Aluminium klorida bersifat higroskopis, mempunyai afinitas yang kuat terhadap air. Ini menguap di udara lembap dan mendesis ketika dicampur dengan air karena ion Cl− digantikan dengan molekul H2O dalam kisi-kisinya untuk membentuk heksahidrate AlCl3·6H2O (juga berwarna putih kekuningan). Fase anhidrat tidak dapat diperoleh kembali pada pemanasan karena HCl hilang menyisakan aluminium hidroksida dan alumina (aluminium oksida):
Pada pemanasan kuat (~400 °C), aluminium oksida terbentuk dari aluminium hidroksida melalui:
Larutan akuatik Templat:Chem2 adalah ionik sehingga menghantarkan listrik dengan baik. Larutan semacam ini dijumpai bersifat asam, menandakan hidrolisis parsial ion Templat:Chem2. Reaksinya dapat dijelaskan secara sederhana sebagai:
Larutan akuatik berperlaku sama seperti garam aluminium lainnya yang mengandung ion Templat:Chem2 terhidrasi, membentuk endapan gelatin aluminium hidroksida pada saat direaksikan dengan natrium hidroksida encer:
Sintesis
Aluminium klorida diproduksi dalam skala besar dengan cara reaksi eksotermik logam aluminium dengan klorin atau hidrogen klorida pada temperatur antara Templat:Convert.[2]
Aluminium klorida dapat terbentuk melalui reaksi pengusiran tunggal antara tembaga klorida dan logam aluminium.
Pada tahun 1993 di AS, sekitar 21.000 ton Templat:Chem2 diproduksi, tidak termasuk jumlah yang digunakan dalam produksi aluminium.[4]
Aluminium triklorida hidrat dibuat dengan melarutkan aluminium oksida dalam asam klorida. Aluminium logam juga mudah larut dalam asam klorida ─ membebaskan gas hidrogen dan menghasilkan panas. Memanaskan padatan ini tidak menghasilkan aluminium triklorida anhidrat, karena senyawa heksahidratnya terdekomposisi menjadi aluminium oksida ketika dipanaskan hingga Templat:Convert:[4]
Aluminium juga membentuk klorida yang lebih rendah, aluminium(I) klorida (AlCl), tetapi ini sangat tidak stabil dan hanya dikenal dalam fase uapnya.[2]
Penggunaan
Aluminium triklorida anhidrat
Templat:Chem2 mungkin merupakan asam Lewis yang paling banyak digunakan dan juga salah satu yang paling kuat. Senyawa ini banyak ditemukan dalam aplikasi industri kimia sebagai katalis untuk reaksi Friedel–Crafts, baik asilasi maupun alkilasi. Produk pentingnya adalah deterjen dan etilbenzena. Ia juga digunakan dalam reaksi polimerisasi dan isomerisasi hidrokarbon.
Reaksi Friedel–Crafts[3] merupakan pengguna utama aluminium klorida, misalnya dalam preparasi antrakuinon (untuk bahan pewarna industri) dari benzena dan fosgen.[2] Secara umum reaksi Friedel–Crafts, asil klorida atau alkil halida bereaksi dengan sistem aromatik sebagai berikut:[3]

Reaksi alkilasi lebih banyak digunakan daripada reaksi asilasi , meskipun praktiknya lebih menuntut perhatian teknis karena reaksi lebih lamban. Untuk kedua reaksi, aluminium klorida, bahan beserta peralatan lainnya harus kering, meskipun jejak kelembaban diperlukan agar reaksi dapat berlangsung. Masalah umum dengan reaksi Friedel–Crafts adalah bahwa katalis aluminium klorida kadang-kadang diperlukan dalam jumlah stoikiometris penuh, karena membentuk kompleks kuat dengan produk. Komplikasi ini kadang-kadang menghasilkan limbah korosif dalam jumlah besar. Untuk alasan ini dan sejenisnya, telah dicari katalis yang lebih dapat didaur ulang atau ramah lingkungan. Dengan demikian, penggunaan aluminium triklorida di beberapa aplikasi telah digantikan oleh zeolit.
Aluminium klorida dapat juga digunakan untuk memasukkan gugus aldehida ke dalam cincin aromatik, contohnya dalam reaksi Gattermann-Koch yang menggunakan karbon monoksida, hidrogen klorida dan ko-katalis tembaga(I) klorida.[5]

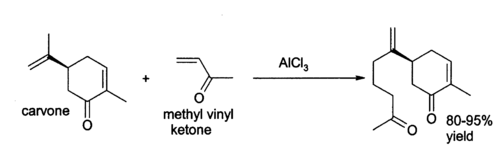
Aluminium klorida banyak digunakan dalam berbagai macam aplikasi kimia organik lainnya.[6] Misalnya, ia dapat mengkatalisis "reaksi ena", seperti adisi 3-buten-2-on (metil vinil keton) menjadi karvona:[7]
AlCl3 juga banyak digunakan untuk reaksi polimerisasi dan isomerisasi hidrokarbon. Contoh penting antara lain pembuatan etilbenzena, yang digunakan untuk membuat stirena sebagai bahan baku polistirena, dan juga produksi dodesilbenzena, yang digunakan untuk pembuatan deterjen.[2]
Aluminium klorida yang dikombinasikan dengan aluminium dan dengan adanya suatu arena dapat digunakan untuk mensintesis kompleks logam bis(arena), misalnya bis(benzena)kromium, dari halida logam tertentu melalui apa yang disebut sintesis Fischer-Hafner.
Aluminium klorida hidrat
Heksahidratnya memiliki sedikit aplikasi, tetapi aluminium klorohidrat pada konsentrasi rendah adalah komponen umum dalam antiperspiran.[4] Penderita Hiperhidrosis memerlukan konsentrasi yang lebih tinggi (12% atau lebih tinggi), dijual dengan merek seperti Xeransis, Drysol, DryDerm, sunsola, Maxim, Odaban, CertainDri, B+Drier, Chlorhydrol, Anhydrol Forte dan Driclor.
Simetri dan momen dipol
Aluminium klorida berada dalam kelompok D3h dalam bentuk monomernya dan D2h dalam bentuk dimernya. Bagaimanapun, kedua bentuk aluminium klorida, tidak memiliki momen dipol karena momen dipol ikatan meniadakan satu sama lain.
Keselamatan
AlCl3 anhidrat bereaksi hebat dengan basa, sehingga diperlukan tindakan pencegahan yang sesuai. Hal ini dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan jika terhirup atau saat kontak.
Aluminium klorida telah ditetapkan sebagai neurotoksin.[8][9][10][11]
Referensi
Pranala luar
- International Chemical Safety Card 1125
- Index of Organic Synthesis procedures that utilize AlCl3
- The period 3 chlorides
- Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts
- ↑ Sebaliknya, AlBr3 memiliki lebih banyak struktur molekul, dengan pusat Al3+ berada pada lubang tetrahedral dari kisi closed-packed ion Br−: Templat:Cite
- ↑ 2,0 2,1 2,2 2,3 2,4 Templat:Cite
- ↑ 3,0 3,1 3,2 Templat:Cite
- ↑ 4,0 4,1 4,2 Templat:Cite
- ↑ Templat:Cite
- ↑ Templat:Cite
- ↑ Templat:Cite journal
- ↑ Templat:Cite journal
- ↑ Templat:Cite journal
- ↑ Templat:Cite journal
- ↑ Templat:Cite journal