Konstanta disosiasi asam
Templat:Asam dan basa Konstanta disosiasi asam (Ka) atau konstanta keasaman adalah sebuah konstanta atau tetapan keseimbangan spesifik untuk sebuah asam dan basa konjugasinya di sebuah larutan berair.[1] Konstanta ini merupakan konstanta kesetimbangan untuk suatu reaksi kimia
yang dikenal sebagai disosiasi dalam konteks reaksi asam-basa. Spesi kimia HA adalah suatu asam yang terdisosiasi menjadi Templat:Chem2, basa konjugasi dari asam tersebut dan suatu ion hidrogen, Templat:Chem2.Templat:Efn Sistem dikatakan dalam kesetimbangan ketika konsentrasi komponennya tidak akan berubah dari waktu ke waktu, karena reaksi maju dan mundur terjadi dengan laju yang sama.[2]
Konstanta disosiasi didefinisikan sebagaiTemplat:Efn
- or
dengan kuantitas dalam tanda kurung mewakili konsentrasi spesi pada kesetimbangan.Templat:Efn[3]
Definisi
Menurut definisi awal menurut Arrhenius, asam adalah zat yang berdisosiasi dalam larutan berair, melepaskan ion hidrogen Templat:Chem2 (suatu proton):[4]
Tetapan kesetimbangan untuk reaksi disosiasi ini dikenal sebagai konstanta disosiasi. Proton yang dibebaskan bergabung dengan molekul air menghasilkan ion hidronium (atau oksonium) Templat:Chem2 (proton telanjang tidak ada dalam larutan), sehingga Arrhenius kemudian mengusulkan bahwa disosiasi harus ditulis sebagai reaksi asam-basa:

Brønsted dan Lowry menggeneralisasi ini lebih lanjut ke dalam suatu reaksi pertukaran proton:[5][6][7]
Asam kehilangan proton, meninggalkan basa konjugasinya; proton dipindahkan ke basa, menghasilkan asam konjugasi. Untuk larutan encer dari asam HA, basanya adalah air; basa konjugasinya adalah Templat:Chem2 dan asam konjugasinya adalah ion hidronium. Definisi Brønsted–Lowry berlaku pula untuk jenis pelarut lain, seperti dimetil sulfoksida: pelarut S bertindak sebagai basa, menerima proton dan membentuk asam konjugasi Templat:Chem2.
Dalam kimia larutan, adalah hal yang biasa untuk menggunakan Templat:Chem2 sebagai singkatan untuk ion hidrogen terlarut, terlepas dari pelarutnya. Dalam larutan berair Templat:Chem2 menyatakan ion hidronium tersolvasi dan bukan proton.[8][9]
Penunjukan asam atau basa sebagai "konjugat" tergantung pada konteksnya. Asam konjugasi Templat:Chem2 dari basa B berdisosiasi menurut persamaan
yang merupakan kebalikan dari kesetimbangan
Ion hidroksida Templat:Chem2, suatu basa yang sangat dikenal, di sini bertindak sebagai basa konjugasi dari asam berair. Asam dan basa dengan demikian masing-masing dianggap hanya sebagai donor dan akseptor proton.
Definisi yang lebih luas dari disosiasi asam meliputi hidrolisis, suatu proses yang melibatkan pembentukan proton oleh adanya pemisahan molekul air. Misalnya, asam borat (Templat:Chem2) menghasilkan Templat:Chem2 seperti layaknya donor proton,[10] namun telah dikonfirmasi melalui spektroskopi Raman bahwa hal ini disebabkan oleh kesetimbangan hidrolisis:[11]
Serupa dengan itu, hidrolisis ion logam menyebabkan ion seperti Templat:Chem2 berperilaku layaknya asam lemah:[12]
Menurut definisi awal Lewis, asam adalah suatu zat yang menerima pasangan elektron untuk membentuk ikatan kovalen koordinasi.[13]
Tetapan kesetimbangan
Konstanta disosiasi asam adalah contoh khusus dari konstanta kesetimbangan. Disosiasi asam monoprotik, HA, dalam larutan encer dapat ditulis sebagai
Konstanta kesetimbangan termodinamika Templat:Tmath dapat didefinisikan sebagai[14]
dengan Templat:Math menyatakan aktivitas, pada kesetimbangan, dari spesi kimia X. Templat:Tmath adalah tanpa dimensi karena aktivitas tidak berdimensi. Aktivitas produk disosiasi ditempatkan di pembilang, aktivitas reaktan ditempatkan di penyebut. Lihat koefisien aktivitas untuk turunan dari ungkapan ini.
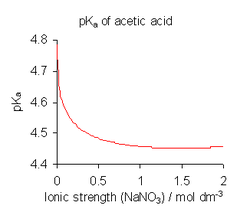
Karena aktivitas adalah hasil kali dari konsentrasi dan koefisien aktivitas (γ) definisi ini juga dapat ditulis sebagai
dengan Templat:Tmath mewakili konsentrasi HA dan Templat:Tmath adalah hasil bagi dari koefisien aktivitas.
Basa dan kebasaan
Konstanta kesetimbangan Kb untuk basa biasanya didefinisikan sebagai konstanta asosiasi dari protonasi basa, B, membentuk asam konjugasi, Templat:Chem2.
Menggunakan penalaran yang mirip dengan yang digunakan sebelumnya
Kb terkait dengan Ka untuk asam konjugasi. Dalam air, konsentrasi ion hidroksida., Templat:Chem2, berhubungan dengan konsentrasi ion hidrogen Templat:Chem2, karenanya
Substitusi ekspresi untuk Templat:Chem2 ke dalam ekspresi untuk Kb menghasilkan
Ketika Ka, Kb dan Kw ditentukan di bawah kondisi suhu dan kekuatan ion yang sama, maka, dengan mengambil kologaritma, bahwa pKb = pKw − pKa. Dalam larutan berair pada 25 °C, pKw adalah 13,9965,[15] sehingga
Faktor yang mempengaruhi nilai pKa
Termodinamika
Konstanta kesetimbangan terkait dengan perubahan Energi Gibbs standar untuk reaksi, sehingga untuk konstanta disosiasi asam
- .
R adalah konstanta gas dan T adalah suhu mutlak. Perhatikan bahwa Templat:Nowrap dan Templat:Nowrap. Pada 25 °C, ΔGTemplat:Sup dalam kJ·mol−1 ≈ 5.708 pKa (1 kJ·mol−1 = 1000 joule per mol). Energi bebas terdiri dari entalpi dan entropi.[10]
Perubahan entalpi standar dapat ditentukan dengan kalorimetri atau dengan menggunakan persamaan van 't Hoff, meskipun metode kalorimetri lebih disukai. Ketika perubahan entalpi standar dan konstanta disosiasi asam telah ditentukan, perubahan entropi standar dapat dengan mudah dihitung dari persamaan di atas. Dalam tabel berikut, istilah entropi dihitung dari nilai eksperimen pKa dan ΔHTemplat:Sup. Data dipilih secara kritis dan dirujuk pada 25 °C dan kekuatan ion nol, dalam air.[10]
| Senyawa | Kesetimbangan | pKa | ΔGTemplat:Sup (kJ·molTemplat:Sup)Templat:Efn | ΔHTemplat:Sup (kJ·molTemplat:Sup) | −TΔSTemplat:Sup (kJ·molTemplat:Sup)Templat:Efn |
|---|---|---|---|---|---|
| HA = Asam asetat | HA Templat:Eqm H+ + A− | 4.756 | 27.147 | −0.41 | 27.56 |
| H2A+ = GlisinaH+ | H2A+ Templat:Eqm HA + H+ | 2.351 | 13.420 | 4.00 | 9.419 |
| HA Templat:Eqm H+ + A− | 9.78 | 55.825 | 44.20 | 11.6 | |
| H2A = Asam maleat | H2A Templat:Eqm HA− + H+ | 1.92 | 10.76 | 1.10 | 9.85 |
| HA− Templat:Eqm H+ + A2− | 6.27 | 35.79 | −3.60 | 39.4 | |
| H3A = Asam sitrat | H3A Templat:Eqm H2A− + H+ | 3.128 | 17.855 | 4.07 | 13.78 |
| H2A− Templat:Eqm HA2− + H+ | 4.76 | 27.176 | 2.23 | 24.9 | |
| HA2− Templat:Eqm A3− + H+ | 6.40 | 36.509 | −3.38 | 39.9 | |
| H3A = Asam borat | H3A Templat:Eqm H2A− + H+ | 9.237 | 52.725 | 13.80 | 38.92 |
| H3A = Asam fosfat | H3A Templat:Eqm H2A− + H+ | 2.148 | 12.261 | −8.00 | 20.26 |
| H2A− Templat:Eqm HA2− + H+ | 7.20 | 41.087 | 3.60 | 37.5 | |
| HA2− Templat:Eqm A3− + H+ | 12.35 | 80.49 | 16.00 | 54.49 | |
| HA− = Hidrogen sulfat | HA− Templat:Eqm A2− + H+ | 1.99 | 11.36 | −22.40 | 33.74 |
| H2A = Asam oksalat | H2A Templat:Eqm HA− + H+ | 1.27 | 7.27 | −3.90 | 11.15 |
| HA− Templat:Eqm A2− + H+ | 4.266 | 24.351 | −7.00 | 31.35 |
| Senyawa | Kesetimbangan | pKa | ΔHTemplat:Sup (kJ·molTemplat:Sup) | −TΔSTemplat:Sup (kJ·molTemplat:Sup) |
|---|---|---|---|---|
| B = Amonia | HB+ Templat:Eqm B + H+ | 9.245 | 51.95 | 0.8205 |
| B = Metilamina | HB+ Templat:Eqm B + H+ | 10.645 | 55.34 | 5.422 |
| B = Trietilamina | HB+ Templat:Eqm B + H+ | 10.72 | 43.13 | 18.06 |
Nilai untuk zat yang umum
Terdapat berbagai teknik untuk menentukan nilai pKa dari suatu zat kimia, menyebabkan beberapa perbedaan antara sumber yang berbeda. Nilai yang diukur dengan baik biasanya berada dalam jarak 0,1 unit satu sama lain. Data yang disajikan di sini diambil di 25 °C dalam air.[6][16] Lebih banyak nilai dapat ditemukan di bagian Termodinamika, di atas. Tabel pKa dari asam-asam karbon, yang diukur dalam DMSO, dapat ditemukan pada halaman karbanion.
| Zat kimia | Kesetimbangan | pKa |
|---|---|---|
| BH = Adenina | BH Templat:Eqm B− + H+ | 4,17 |
| Templat:Chem Templat:Eqm BH + H+ | 9,65 | |
| H3A = Asam arsenat | H3A Templat:Eqm H2A− + H+ | 2,22 |
| H2A− Templat:Eqm HA2− + H+ | 6,98 | |
| HA2− Templat:Eqm A3− + H+ | 11,53 | |
| HA = Asam benzoat | HA Templat:Eqm H+ + A− | 4,204 |
| HA = Asam butirat | HA Templat:Eqm H+ + A− | 4,82 |
| H2A = Asam kromat | H2A Templat:Eqm HA− + H+ | 0,98 |
| HA− Templat:Eqm A2− + H+ | 6,5 | |
| B = Kodein | BH+ Templat:Eqm B + H+ | 8,17 |
| HA = Kresol | HA Templat:Eqm H+ + A− | 10.29 |
| HA = Asam format | HA Templat:Eqm H+ + A− | 3,751 |
| HA = Asam fluorida | HA Templat:Eqm H+ + A− | 3,17 |
| HA = Asam sianida | HA Templat:Eqm H+ + A− | 9,21 |
| HA = Hidrogen peroksida (90%) | HA Templat:Eqm H+ + A− | 11,7 |
| HA = Asam laktat | HA Templat:Eqm H+ + A− | 3.86 |
| HA = Asam propionat | HA Templat:Eqm H+ + A− | 4,87 |
| HA = Fenol | HA Templat:Eqm H+ + A− | 9,99 |
| H2A = Asam L-(+)-Askorbat | H2A Templat:Eqm HA− + H+ | 4,17 |
| HA− Templat:Eqm A2− + H+ | 11,57 |
Lihat pula
- Asidosis
- Alkalosis
- Kesetimbangan kimia
- Fungsi keasaman Hammett: ukuran keasaman yang digunakan untuk larutan asam kuat yang sangat pekat, termasuk superasam.
- pH
Catatan
Templat:Notelist Templat:Reflist
Referensi
Bacaan lebih lanjut
- Templat:Cite book (Previous edition published as Templat:Cite book)
- Templat:Cite book
- Templat:Housecroft3rd (Non-aqueous solvents)
- Templat:Cite book (translation editor: Mary R. Masson)
- Templat:Cite book
- Templat:Cite book Chapter 4: Solvent Effects on the Position of Homogeneous Chemical Equilibria.
- Templat:Cite book
Pranala luar
- Acidity–Basicity Data in Nonaqueous Solvents Bibliografi yang luas dari nilai pKa dalam DMSO, asetonitril, THF, heptana, 1,2-dikloroetana, dan dalam fasa gas
- Curtipot Perangkat gratis semua-jadi-satu untuk perhitungan kesetimbangan pH dan asam-basa serta untuk simulasi dan analisis kurva titrasi potensiometri dengan lembar bentang
- SPARC Physical/Chemical property calculator Termasuk basis data dengan nilai pKa fase berair, tidak berair, dan gas daripada yang dapat dicari menggunakan SMILES atau nomor registrasi CAS
- Aqueous-Equilibrium Constants nilai pKa untuk berbagai asam dan basa. Termasuk tabel beberapa hasil kali kelarutan
- Panduan gratis interpretasi dan pengukuran pKa dan log p Templat:Webarchive Penjelasan tentang relevansi sifat-sifat ini dengan farmakologi
- Free online prediction tool (Marvin) pKa, log p, log d dll. Dari ChemAxon
- Diagram pKa [1] oleh David A. Evans
Templat:Kesetimbangan kimia Templat:Larutan kimia
- ↑ Templat:Cite web
- ↑ Templat:Cite book
- ↑ Templat:Cite book
- ↑ Templat:Cite book Chapter 6: Acid–Base and Donor–Acceptor Chemistry
- ↑ Templat:Cite book Termasuk pembahasan banyak asam organik Brønsted.
- ↑ 6,0 6,1 Templat:Cite book Chapter 5: Acids and Bases
- ↑ Templat:Housecroft3rd Chapter 6: Acids, Bases and Ions in Aqueous Solution
- ↑ Templat:Cite journal
- ↑ Templat:Cite journal
- ↑ 10,0 10,1 10,2 Templat:Cite journal
- ↑ Templat:Cite book
- ↑ Templat:Cite book Section 9.1 "Acidity of Solvated Cations" lists many pKa values.
- ↑ Templat:Cite book hlm. 698
- ↑ Templat:Cite book Chapter 2: Activity and Concentration Quotients
- ↑ Templat:Cite book Section D–152
- ↑ Templat:Cite book Chapter 8